Entrevista a la Dra. María Teresa Pérez Gracia
"La aparición y propagación de las infecciones causadas por bacterias que son resistentes al tratamiento con antibióticos constituye una de las amenazas más graves a las que se enfrenta la salud pública y supone uno de los retos más importantes para la medicina moderna"
Realmente hay muchos episodios en la historia de la medicina que supusieron una revolución, pero sin lugar a dudas uno de los más importantes fue el descubrimiento de los antibióticos y su utilización como quimioterápicos. Hasta ese momento, la mayoría de las infecciones resultaban mortales y un simple corte en una mano podía derivar en una grave septicemia que llevase a una persona a la muerte. Aunque nos puede parecer que los antibióticos tienen una larga tradición de uso en medicina, su utilización es relativamente reciente. Sin duda, uno de los hitos más conocidos en relación a la historia de los antibióticos fue el descubrimiento de la penicilina por Alexander Fleming en 1928, aunque ya a principios del siglo XX se empezó a utilizar el primer fármaco antibiótico, la arsfenamina, descubierta por el alemán Paul Ehrlich y comercializada con el nombre de Salvarsan para el tratamiento de la sífilis.

Desde entonces la medicina, la investigación y la industria farmacéutica han trabajado incansablemente para identificar y diseñar diferentes antibióticos con los que combatir las enfermedades infecciosas. Como fruto de ello, hoy día estamos familiarizados con ellos, los tomamos cuando nuestro cuerpo sufre alguna infección que necesita ser tratada, y confiamos ciegamente en su eficacia. Pero, ¿qué ocurre cuando un antibiótico deja de ser efectivo frente a una infección? Quizá no nos hemos planteado esta cuestión, aunque para la Organización Mundial de la Salud es un problema prioritario: las bacterias que causan las enfermedades infecciosas pueden desarrollar resistencias a los antibióticos haciendo difícil en muchos casos el tratamiento de determinadas enfermedades. La ciencia es consciente de ello y afronta por tanto el gran reto de encontrar soluciones viables y efectivas que puedan poner solución a esta problemática.
Para saber más sobre la resistencia a los antibióticos y el desarrollo de nuevos fármacos para luchar contra las infecciones, hemos hablado con la doctora María Teresa Pérez Gracia, investigadora principal dentro de la línea de Diagnóstico Molecular en Microbiología Clínica y Catedrática de Microbiología en la Universidad CEU Cardenal Herrera de Valencia. La Dra. Pérez Gracia ha publicado numerosos trabajos científicos centrados en el problema del desarrollo de resistencia a antibióticos y ha participado en iniciativas enfocadas precisamente a la búsqueda de nuevos antibióticos y a la concienciación para el buen uso de estos.

Dra. María Teresa Pérez Gracia - Universidad CEU Cardenal Herrera
My Scientific Journal. Al leer tus trabajos, una evidencia emerge como premisa inicial, y es que la aparición de microorganismos resistentes es algo que afecta a toda la población mundial, y preocupa cada vez más a la Organización Mundial de la Salud, ¿cuál es tu opinión experta en cuanto al avance de la investigación en este campo?
María Teresa Pérez Gracia. En la actualidad y según datos del Centro Europeo para la Prevención y Control de las Enfermedades (ECDC), la resistencia a los antibióticos causa 33.000 muertes cada año en Europa y 750.000 en el mundo. Y según la OCDE, de aquí a 2050 morirán 15 españoles cada día por esta causa. El aumento de la resistencia a los antibióticos se debe a diversos factores, pero el uso inapropiado e indiscriminado de estos medicamentos es uno de los que más contribuyen a la aparición de este fenómeno, que causa un gran impacto clínico, epidemiológico y microbiológico. También es importante señalar que, hace más de 30 años que no salen al mercado nuevos antibióticos y los descubiertos hasta ahora son cada vez menos efectivos por el mal uso que hemos hecho de ellos. Si hace cuarenta años la penicilina era eficaz frente a todo tipo de bacterias, ahora algunas de ellas son ya resistentes a sus efectos, por su rápida capacidad de evolución cada vez resulta más difícil curar las infecciones bacterianas con el arsenal terapéutico de antibióticos conocidos. Con todos estos datos, la Organización Mundial de la Salud (OMS), ha estimado que la resistencia bacteriana a los antibióticos causará en el año 2050, 10 millones de muertes, superando a las producidas por cáncer, por lo que si no se toman las medidas adecuadas estaremos ante un grave problema de emergencia sanitaria a nivel mundial. Por lo tanto, es necesario que los gobiernos tomen conciencia de este problema y dediquen recursos para la investigación y descubrimiento de nuevos antibióticos y que la industria farmacéutica también siga investigando en este campo, que hasta la fecha estaba bastante abandonado.Además de dedicar recursos a la investigación, es muy importante concienciar a la población sobre el uso adecuado de los antibióticos que ya tenemos para que, en la medida de lo posible, no se cumplan estos malos augurios. En este sentido hay varias estrategias puestas en marcha. Una de ellas es el proyecto MicroMundo, auspiciado por la Sociedad Española de Microbiología, en el que hay involucradas más de 30 universidades en España y Portugal, que nace a partir de una iniciativa de la Universidad de Yale en 2012, denominada Small World Inititative (SWI) y que se refundó en 2018 como Tiny Earth, y en la que actualmente están involucradas 200 universidades a nivel mundial, entre ellas nuestra Universidad CEU Cardenal Herrera. Este proyecto internacional de ciencia ciudadana en el reto de salud que supone la búsqueda de nuevos antibióticos en el entorno natural, pretende involucrar a toda la sociedad pero especialmente a los más jóvenes, universitarios y preuniversitarios, promoviendo en ellos la vocación científica y, al mismo tiempo, concienciar sobre el buen uso de los antibióticos ya existentes, para frenar el avance de las resistencias que las bacterias desarrollan frente a ellos.
MSCJ. Leyendo una tus contribuciones recientes, en la que revisas la problemática del tratamiento de infecciones causadas por Neisteria gonorrhoeae, nos surge una pregunta genérica sobre el tema y es que, aunque muchas bacterias pueden presentar resistencia al tratamiento con antibióticos, ¿por qué algunas en particular manifiestan una tendencia tan alta a desarrollar esta resistencia (como es el caso de N. gonorrhoeae)?MTPG. Aunque todas las bacterias mutan y por lo tanto se pueden volver resistentes a los antibióticos, hay determinados microorganismos, como puede ser N. gonorrhoeae, que presentan una mayor capacidad de desarrollar diferentes mecanismos de resistencia a los antibióticos. En este sentido, la OMS publicó en 2017 una lista de bacterias “prioritarias” por su resistencia a los antibióticos y peligrosas para la salud humana. La lista de la OMS se divide en tres categorías con arreglo a la urgencia en que se necesitan los nuevos antibióticos: prioridad crítica, alta o media. El grupo de prioridad crítica incluye las bacterias multirresistentes que son especialmente peligrosas en hospitales, residencias de ancianos y entre los pacientes que necesitan ser atendidos con dispositivos como ventiladores y catéteres intravenosos. Entre estas bacterias se incluyen las siguientes: Acinetobacter, Pseudomonas y varias enterobacterias como Klebsiella, Escherichia coli, Serratia, y Proteus. Son bacterias que pueden provocar infecciones graves y a menudo letales, como infecciones respiratorias y septicemias (cuando pasan al torrente sanguíneo). Los niveles segundo y tercero de la lista –las categorías de prioridad alta y media– contienen otras bacterias que exhiben una farmacorresistencia creciente y provocan enfermedades comunes como la gonorrea o intoxicaciones alimentarias por salmonela (salmonelosis).
MSCJ. ¿Qué estrategias tienen las bacterias para desarrollar la resistencia a antibióticos y por qué es tan difícil llegar controlar farmacológicamente esta capacidad de los microorganismos?MTPG. Las bacterias, como todos los seres vivos, lo que quieren es seguir viviendo, sea como sea y cuando hay algo que las amenaza, en este caso los antibióticos, desarrollan estrategias para hacerse resistentes. Por lo tanto, la resistencia, en principio, es un fenómeno natural, aunque el uso inapropiado e indiscriminado de estos fármacos en el ser humano y los animales está acelerando este proceso lo que está produciendo un gran impacto clínico, epidemiológico y microbiológico.Los microorganismos se vuelven resistentes a los antimicrobianos tanto por mutaciones en genes específicos como por adquisición de genes que codifican determinantes de resistencia transferidos de un microorganismo a otro. Hoy en día, debido al mal uso y abuso de los antimicrobianos estos patógenos resistentes se seleccionan con más facilidad aumentando la prevalencia de microorganismos multirresistentes (MR). Los mecanismos por los que desarrollan esa resistencia son diversos y a veces coexisten en la misma bacteria. Entre estos mecanismos podemos citar las bombas de eflujo, mutaciones que modifican el sitio de acción de los antimicrobianos, la producción de unas enzimas denominadas beta-lactamasas o la disminución de la permeabilidad al antibiótico. Uno de los más importantes de los citados, es la producción de las beta-lactamasas que degradan a los antibióticos de la familia beta-lactámicos, que es una de las principales y más utilizadas entre los que se encuentran, la penicilina y la amoxicilina. Una vez que una bacteria se hace resistente a un antibiótico, ese efecto ya es irreversible. Y además esa resistencia puede ser transmitida a otras bacterias mediante la adquisición de los genes que codifican determinantes de esa resistencia. Por todos estos motivos es tan difícil controlar a una bacteria que se ha vuelto resistente a un antibiótico.
MSCJ. ¿Cuáles son las estrategias más comunes que la ciencia aborda para enfrentarse a esta problemática?MTPG. La aparición y propagación de las infecciones causadas por bacterias que son resistentes al tratamiento con antibióticos constituye una de las amenazas más graves a las que se enfrenta la salud pública y supone uno de los retos más importantes para la medicina moderna. Combatir la resistencia antibiótica también es una prioridad de la Unión Europea (UE), que ha establecido una estrategia común frente a esta cuestión. En noviembre del año 2011, el Parlamento Europeo publicó una resolución no legislativa por la que se estableció un Plan Director de Acción sobre Resistencias Antimicrobianas (2011-2016) que estimuló la puesta en marcha de planes nacionales en 13 países. Entre ellos estaba España, que aprobó en 2014 su Plan Nacional frente a la Resistencia a los Antibióticos (PRAN) que sienta las bases de una estrategia para frenar este problema de salud pública, entre las cuales se halla la potenciación de la investigación, el desarrollo y la innovación en este ámbito. El segundo Plan de Acción sobre Resistencia a los Antibióticos de la UE, publicado en junio de 2017, estableció el marco global para una acción más amplia destinada a reducir la aparición y propagación de la resistencia a los antibióticos y a incrementar, dentro y fuera de la UE, la investigación y la disponibilidad de nuevos antibióticos. Este nuevo plan de acción de la Comisión Europea establece los siguientes objetivos clave:- Convertir Europa en una región de buenas prácticas en todos los aspectos relacionados con la resistencia a los antibióticos (vigilancia, prevención, control, accesibilidad y medioambiente).
- Potenciar la investigación, el desarrollo y la innovación en este ámbito.
- Coordinar todas las acciones internacionales.
MSCJ. La búsqueda de antibióticos y tratamientos alternativos a los antibióticos es un área de mucho peso en la investigación farmacológica, ¿qué papel tienen las aproximaciones informáticas en este campo? ¿Y el reposicionamiento de fármacos?MTPG. En el actual contexto de la creciente aparición de resistencias a los antibióticos conocidos, son necesarios métodos rápidos y económicos para la ampliación inmediata del arsenal terapéutico del que disponemos en la actualidad. En este sentido, hay que destacar el diseño y desarrollo de modelos matemático-topológicos de predicción de actividad antibacteriana que permiten la obtención de nuevos fármacos con capacidad antibacteriana y que son herramientas alternativas ante la reducción de las inversiones por parte de la industria farmacéutica en este ámbito. Así dentro de estos métodos estarían los denominados QSAR (Quantitative Structure-Activity Relationships) que desempeñan un papel importante, ya que aportan información útil para el diseño racional de nuevas moléculas con un coste mínimo. La gran ventaja de estos métodos QSAR es que son capaces de predecir la actividad farmacológica de un compuesto sin la necesidad de obtenerlo o sintetizarlo previamente. Esto ha hecho que la llamada Química Computacional y la Química Combinatoria Virtual hayan tenido un gran auge en los últimos años. En concreto, nuestro equipo utiliza el Método de Conectividad Molecular, que consiste en la obtención de una serie de índices topológicos que se calculan a partir de la estructura de una molécula. De esta forma, podemos clasificar un compuesto como activo o no activo frente a una determinada actividad farmacológica utilizando técnicas de reconocimiento de patrón como el análisis lineal discriminante, las redes neuronales o el análisis de componentes principales.Actualmente, comercializar una nueva molécula cuesta entre 2000 y 3000 millones de euros y es un proceso que conlleva entre 13 y 15 años. Esto es un importante factor disuasorio para la industria farmacéutica, ya que no interesa realizar una inversión así en un antibiótico que, además de ser un tratamiento agudo de corta duración, puede empezar a generar resistencias a los pocos años de estar comercializado y, por lo tanto, no ser rentable. Sin embargo, se estima que reutilizar un fármaco que ya ha pasado los ensayos preclínicos supone una inversión de 300 millones de euros y 6-7 años. Por esta razón, el reposicionamiento de fármacos es una buena alternativa para acelerar la llegada de nuevas terapias al mercado. Consiste en usar medicamentos que ya están comercializados y que tienen otros fines terapéuticos para tratar infecciones por bacterias multirresistentes. Este campo ofrece un método alternativo y económico para la rápida identificación de nuevos agentes antibacterianos.
MSCJ. ¿Existen hoy día tratamientos alternativos al uso de antibióticos que pudiesen generar menos resistencias en los microorganismos?MTPG. Además de lo que hemos comentado arriba, otro método alternativo al uso de antibióticos para tratar infecciones bacterianas resistentes a los antibióticos es la terapia con bacteriófagos (fagoterapia). Los bacteriófagos son virus que infectan y parasitan exclusivamente a las bacterias. Se considera que son los microorganismos más ubicuos y abundantes del planeta, responsables de regular de forma natural las poblaciones bacterianas. Tienen un tamaño que varía entre 20 y 200 nm, unas 10 veces inferior al de una bacteria. Los bacteriófagos tienen la capacidad de replicarse en el sitio de infección (en presencia de su hospedador), que viene condicionado por una de sus características más importantes, la especificidad. Aunque entre la biodiversidad tan masiva que tienen estos microorganismos hay excepciones, estos virus tienden a ser específicos para un determinado género bacteriano o incluso para una sola especie dentro del mismo. Esto, al aplicarlo como terapia dirigida y al contrario que con los antibióticos, permite respetar la microbiota ya que no se atacaría indiscriminadamente a todas las poblaciones bacterianas presentes en el organismo. Aparte de su actividad bactericida, poseen baja toxicidad y pueden penetrar y degradar biofilms, lo que lo convierte en un candidato ideal para atacar bacterias que utilizan este mecanismo y que suelen ser además resistentes a los antibióticos.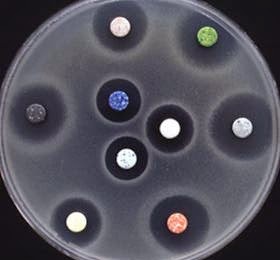
MSCJ. En uno de tus últimos estudios os adentráis en el papel que el uso de antibióticos en la producción animal (concretamente en pollos de engorde) ha tenido y tiene sobre el desarrollo de resistencia a antibióticos en infecciones humanas. En base a tus investigaciones, ¿crees que es posible que lleguemos a un modelo de producción animal sostenible y más acorde con la necesidad de reducir el uso de antibióticos?MTPG. Es necesario e imprescindible que el uso de antibióticos en los animales disminuya y se haga un uso responsable y prudente para conservar su eficacia terapéutica. De hecho, uno de los puntos importantes que aborda el Plan Nacional frente a la Resistencia a los Antibióticos (PRAN), que hemos comentado arriba, es el relativo a la sanidad animal.En este sentido hay que señalar que se ha mejorado el sistema nacional de recogida de datos de ventas de antibióticos de uso veterinario, además se está trabajando en la implementación de un sistema nacional de recogida de datos de prescripción veterinaria de antibióticos y se han puesto en marcha los Programa REDUCE en distintos sectores ganaderos. En este contexto, el Acuerdo para la Reducción del Uso de Colistina en Porcino, firmado por empresas que representan el 80% del sector, ya ha conseguido una reducción del consumo de colistina del 97,18 % (2015-2018).
Para abordar este problema, es necesario el enfoque “One Health” (una sola salud), que consiste en abordar este tema como una estrategia global que une las disciplinas de salud humana, veterinaria y ambiental. Aunque el vínculo entre la salud humana y la salud animal es conocido desde tiempos de Aristóteles, el término “OneHealth” (una sola salud) no fue empleado hasta la conferencia de la Wildlife Conservation Society “One World, One Health” en el año 2004. Entre las conclusiones más destacables de dicha reunión fue el reconocimiento del nexo que existe entre los seres humanos, los animales domésticos y la fauna salvaje y el riesgo que las enfermedades de todos y cada uno de ellos supone para el suministro de alimentos, para la economía y para la biodiversidad. Esta fuerte unión entre la salud animal y humana hace hincapié en el uso responsable de los antibióticos, para evitar así la aparición de resistencias.
Para abordar este problema, es necesario el enfoque “One Health” (una sola salud), que consiste en abordar este tema como una estrategia global que une las disciplinas de salud humana, veterinaria y ambiental. Aunque el vínculo entre la salud humana y la salud animal es conocido desde tiempos de Aristóteles, el término “OneHealth” (una sola salud) no fue empleado hasta la conferencia de la Wildlife Conservation Society “One World, One Health” en el año 2004. Entre las conclusiones más destacables de dicha reunión fue el reconocimiento del nexo que existe entre los seres humanos, los animales domésticos y la fauna salvaje y el riesgo que las enfermedades de todos y cada uno de ellos supone para el suministro de alimentos, para la economía y para la biodiversidad. Esta fuerte unión entre la salud animal y humana hace hincapié en el uso responsable de los antibióticos, para evitar así la aparición de resistencias.
El 60% de los agentes patógenos peligrosos para el ser humano son de origen animal. Por lo tanto, hombres y animales tienen en común bacterias patógenas, de tal modo que es indispensable combatirlas y prevenirlas a nivel regional, nacional y mundial. Así pues, para reducir la aparición de fenómenos de resistencia, se precisa una armonización mundial e intersectorial de las estrategias y las medidas con vistas a coordinar mejor las políticas de la salud pública, la sanidad animal y el medioambiente.
La Organización Mundial de la Salud (OMS) advierte que, si no se toman medidas, «el mundo está abocado a una era post-antibiótica». Para combatir estos microorganismos multirresistentes es imprescindible disponer de más recursos y que haya una mayor concienciación de la gravedad del problema. Para ello, es necesario llevar a cabo las siguientes medidas concretas a nivel mundial:
- Reforzar los sistemas ya implementados y establecer nuevos sistemas en países de renta baja y media para la vigilancia y monitoreo de la resistencia antimicrobiana.
- Promover el uso racional de los antibióticos, también en el ámbito veterinario.
- Mejorar la prevención y control de infecciones.
- Fomentar la innovación, investigación y desarrollo de herramientas diagnósticas y nuevos medicamentos para combatir los patógenos resistentes.
MSCJ. En los últimos años, el papel de la microbiota intestinal ha ganado peso como factor implicado en numerosas patologías, desde enfermedades neurodegenerativas, a metabólicas y cardiovasculares. A su vez, el problema de la resistencia a antibióticos en microorganismos motiva la búsqueda de nuevos antibióticos. Dado el caso del descubrimiento de un nuevo antibiótico, ¿crees que sería interesante durante su desarrollo como fármaco evaluar cómo éste podría afectar a la microbiota del organismo tratado?MTPG. Evidentemente que es muy importante evaluar cómo va a incidir ese nuevo fármaco en la microbiota. La microbiota está formada por bacterias, entre otros microorganismos, que están en perfecto equilibrio con nuestro organismo. Se estima que más de cien mil billones (10 14) de bacterias habitan en el organismo humano, siendo este número incluso 10 órdenes de magnitud mayor al número de nuestras células (10 13). Si bien no se han logrado estimar con exactitud estas cifras, hoy en día se conoce que millones de bacterias están jugando un papel esencial en la regulación de numerosos procesos fisiológicos. Entre estos procesos, cabe destacar la actividad de las enzimas digestivas, la síntesis de vitaminas del complejo B, la interacción con el sistema inmunológico, o la protección frente a organismos patógenos, entre otros.Los antibióticos conocidos hasta la fecha actúan frente a las bacterias atacando una parte de su estructura (pared, membrana, ácido nucleico o ribosomas), y no son capaces de diferenciar entre aquellas bacterias que son “buenas” (forman parte de la microbiota) y las “malas” (patógenas). Por lo tanto, actúan frente a todas ellas y por ese motivo, aunque puedan eliminar las bacterias patógenas, también eliminan a las “buenas” produciendo desviaciones de ese equilibrio que hemos comentado antes, y provocar efectos secundarios. Por este motivo, sería interesante encontrar nuevas alternativas de tratamiento de las infecciones, como la fagoterapia que hemos comentado anteriormente, o descubrir nuevos fármacos que actúen en lugares estratégicos y únicos de las bacterias patógenas. Queda mucho camino por delante, es un campo muy apasionante y al que la ciencia debe seguir dedicando esfuerzo y tiempo y la administración destinar recursos económicos para que la multirresistencia bacteriana no se convierta en la segunda pandemia del siglo XXI.
REFERENCIAS
Beatriz Suay-García y María Teresa Pérez-Gracia, (2018). Future Prospects for Neisseria gonorrhoeae Treatment. Antibiotics, Vol. 7(2):49
Documentación y Entrevista
Alba Peña Hidalgo y Beatriz Martínez Poveda para My Scientific Journal
08/09/2020
08/09/2020

Alba Peña HidalgoRedactora My Scientific
Estudiante de Biología

Beatriz Martínez PovedaRedactora My Scientific
Profesora Universidad de Málaga
