Entrevista al Dr. Daniel García González, ERC Starting Grant
El grado de complejidad de un organismo vivo es abrumador si lo estudiamos con un enfoque integral. Cada uno de sus niveles es en sí un intrincado conjunto de múltiples conexiones y estructuras: las células y su funcionamiento, la organización de las diferentes células en tejidos y órganos, la interconexión de los órganos desde puntos de vista anatómico, fisiológico y metabólico… Sin embargo, a pesar de la enorme complejidad para su estudio, los investigadores saben que es fundamental tener en cuenta el mayor número de elementos posibles a la hora de estudiar en profundidad qué le ocurre a nuestro organismo cuando aparece una enfermedad o un daño.
Pensemos en el cerebro, nuestro ordenador central, que posibilita y coordina desde nuestras funciones más básicas a las más complejas. Todos conocemos que los daños en el cerebro, incluso los más pequeños, pueden conllevar daños mucho mayores a nivel de nuestro organismo. ¿Cómo se puede investigar de forma global algo tan complejo como el daño cerebral ocasionado por impactos o por ictus? Un enfoque muy interesante y prometedor es el que ha abordado el Dr. Daniel García González en sus trabajos de investigación, generando modelos computacionales complejos basados en datos clínicos. El enfoque de estos trabajos destaca precisamente por su marcado carácter multidisciplinar, combinando la neurociencia, la medicina, la computación y la bioingeniería mecánica, siendo todo un ejemplo de lo que la ciencia puede llegar a crear cuando profesionales de diversas disciplinas trabajan codo con codo.
Pensemos en el cerebro, nuestro ordenador central, que posibilita y coordina desde nuestras funciones más básicas a las más complejas. Todos conocemos que los daños en el cerebro, incluso los más pequeños, pueden conllevar daños mucho mayores a nivel de nuestro organismo. ¿Cómo se puede investigar de forma global algo tan complejo como el daño cerebral ocasionado por impactos o por ictus? Un enfoque muy interesante y prometedor es el que ha abordado el Dr. Daniel García González en sus trabajos de investigación, generando modelos computacionales complejos basados en datos clínicos. El enfoque de estos trabajos destaca precisamente por su marcado carácter multidisciplinar, combinando la neurociencia, la medicina, la computación y la bioingeniería mecánica, siendo todo un ejemplo de lo que la ciencia puede llegar a crear cuando profesionales de diversas disciplinas trabajan codo con codo.
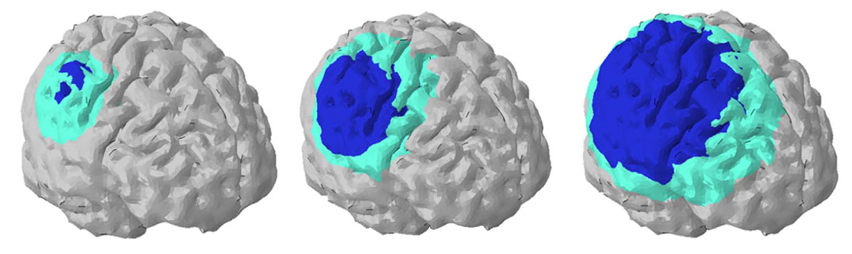
Modelo de daños cerebrales ante diferentes impactos
Para saber más sobre esta apasionante línea de investigación, en My Scientific Journal hemos hablado con el Dr. García González, investigador del Departamento de Mecánica de Medios Continuos y Teoría de Estructuras de la Universidad Carlos III de Madrid, sobre algunos de sus trabajos, en los que se utilizan modelos complejos de cabeza para estudiar situaciones de daño en el cerebro.

Dr. Daniel García González
My Scientific Journal. A lo largo de la historia, se han utilizado muchos materiales diferentes para la reconstrucción del cráneo tras un traumatismo. Tal es el caso de metales como el titanio. En uno de tus trabajos precisamente analizáis dos de los materiales más utilizados hoy día para la fabricación de prótesis craneales, ¿qué características ha de tener un material para ser considerado un buen candidato para la fabricación de estas prótesis?Daniel García González. En base a mi experiencia, cualquier problema que se encuentre en la intersección entre materiales y biología nunca es sencillo, siempre entraña numerosas dificultades. Si hablamos de implantes craneales, o cualquier tipo de implante en general, existen tres perspectivas principales desde las que hay que analizar el problema: las propiedades del material empleado, la geometría del implante (propiedades estructurales) y la biocompatibilidad de éste en cuanto a la integración y la respuesta inmune del cuerpo. En cuanto a las propiedades del material, normalmente se busca un equilibrio entre rigidez (si es fácil o no de deformar) y ductilidad (cuánto puede deformarse sin llegar a romperse). Si pensamos en un polímero, éste puede deformarse mucho sin romperse pero, por el contrario, pequeñas cargas pueden provocar deformaciones de la prótesis dando lugar a cambios en la forma del implante y daños en el cerebro. Por otro lado, si elegimos un material muy rígido (titanio, por ejemplo), aunque el implante no se deforme, va a transmitir esfuerzos muy grandes al hueso que lo rodea y puede traducirse en fracturas de este último. Cuando hablamos de análisis estructural nos referimos a la forma del implante y posibles defectos que presente. Un aspecto muy importante es la presencia de agujeros o tornillos en la prótesis. Éstos hacen que, bajo una misma carga, haya una concentración de esfuerzos en estas zonas y se puedan producir roturas más fácilmente.
Por último, es necesario evaluar cómo responde el sistema inmune y el propio cuerpo al implante. Existen materiales cerámicos porosos que permiten que se desarrolle nuevo tejido óseo dentro de los poros dando lugar a una fijación implante-hueso muy buena. También se está investigando mucho en revestimientos a los materiales de manera que se mejore su biocompatibilidad.
MSCJ. Los resultados de ese análisis muestran que los dos tipos de materiales estudiados presentan algunos “puntos débiles”, o al menos, que sus limitaciones han de ser tenidas en cuenta para la elección de la prótesis a utilizar en función del paciente y su estilo de vida. ¿Estaríamos hablando del concepto de medicina personalizada aplicado a la utilización de prótesis?DGG. En primer lugar, me gustaría destacar que debemos tratar todos estos modelos con mucho cuidado ya que, por muy sofisticados que sean, no dejan de ser modelos que simplifican el problema real y pueden presentar limitaciones. A pesar de esto, representan una herramienta muy potente para, en función del paciente y el problema específico, “probar virtualmente” miles de posibilidades modificando materiales, geometrías o incluso simulando accidentes que pudieran darse tras la operación. De esta forma, los modelos pueden guiar al cirujano y determinar la solución óptima para cada paciente. Una forma de avanzar en esta dirección es automatizar la generación de modelos personalizados para cada paciente para poder dar una respuesta rápida al cirujano. Otra alternativa en la que se está trabajando es el empleo de inteligencia artificial (machine learning). Esta última trata de generar una base de datos muy grande donde se consideren múltiples casos para distintas morfologías del cráneo, tipo y tamaño de fractura, así como material, dimensiones y geometría del implante. De esta manera, dadas las características del paciente se podría encontrar la solución óptima sin necesidad de generar simulaciones nuevas.MSCJ. Nos llama la atención la gran complejidad del modelo computacional de la cabeza que habéis creado para el estudio acerca de las prótesis craneales, incluyendo diferentes tipos de tejidos y estructuras (cuero cabelludo, cráneo, cerebro…). ¿Qué posibilidades tiene el empleo de este modelo tan realista en el campo de la investigación biomédica?
Dr. Daniel García González
DGG. Desde mi punto de vista, lo más interesante de este tipo de modelos es que ofrece la capacidad de reproducir accidentes tales como impactos en la cabeza durante una caída. Usando estas simulaciones podemos introducirnos dentro de cada uno de estos tejidos y ver qué está ocurriendo durante el accidente: ¿se deforma nuestro cráneo? ¿existe una deformación mecánica de nuestro cerebro durante estos impactos? De esta manera podemos tratar de comprender cuáles son las causas de trastornos como pérdida de memoria o dificultad para andar después de este tipo de accidentes.
MSCJ. Precisamente el realismo del modelo podría parecer sacado de una película de ciencia ficción, ¿cómo habéis llegado a tal nivel de cercanía con la realidad?DGG. Tenemos que agradecer la colaboración en este trabajo de expertos en imagen médica y neurocirujanos que nos proporcionaron mucha información para la generación de este modelo. El material de partida consistía en un conjunto de imágenes en dos dimensiones que recorrían la cabeza de un paciente de arriba abajo. En cada una de estas imágenes se identificaron los distintos tejidos (tejidos cerebrales, cráneo, cuero cabelludo, etc). Una vez identificadas las distintas partes de la cabeza para cada zona, se utilizaron algoritmos que posicionan todas estas imágenes en un espacio tridimensional común y generan un volumen conjunto con todos los detalles. Finalmente, la geometría completa se divide en pequeños elementos (elementos finitos) que permiten importar los datos geométricos a programas de simulación donde resolver las ecuaciones físicas y matemáticas.MSCJ. En otro de tus trabajos aplicáis un modelo computarizado de cabeza para simular un episodio de ictus isquémico y explorar así nuevas herramientas para ayudar al pronóstico del paciente y predecir la evolución de la enfermedad (enlace). En este modelo incluís como uno de sus elementos la red vascular en el cerebro, ¿piensas que podría utilizarse para simular el desarrollo de tumores cerebrales altamente invasivos, como el glioblastoma, en el que se da un proceso de angiogénesis (formación de nuevos vasos) muy activo?DGG. Sí, la idea de este trabajo es parecida al de los implantes craneales. Se trata de desarrollar modelos computacionales que nos permitan simular accidentes o procesos patológicos en humanos y, a partir de estos datos, anticiparnos al proceso o encontrar una solución óptima al mismo. Para responder a la pregunta concreta sobre tumores cerebrales, hay que explicar primero las partes que componen el modelo. Hasta ahora hemos hablado principalmente del dominio espacial del modelo, es decir, la geometría de cada uno de los tejidos o estructuras de la cabeza y cómo están ligadas unas a otras. Sin embargo, lo más complicado del modelo es la descripción del comportamiento mecánico (y/u otros comportamientos físicos acoplados al mecánico). Con esto, me refiero a definir en forma de ecuaciones matemáticas cómo va a responder nuestro sistema a un determinado estímulo o condición patológica. Por lo tanto, cualquier problema que se plantee puede ser, a priori, modelado y la pregunta que tenemos que hacernos es cómo de realistas son los resultados que obtenemos. De esta forma, si entendemos la física detrás del problema a modelar podemos plasmarlo en sistemas de ecuaciones que, junto con la definición de los detalles geométricos, nos proporcionen predicciones de cómo va a evolucionar un proceso patológico. Volviendo a tu pregunta, esto último también incluye posibles transformaciones y creación de nuevos tejidos (aunque la dificultad de esto es enorme).MSCJ. Para finalizar, y desde tu experta opinión, ¿crees que una de las claves para dar un paso más en la medicina del futuro es la aplicación de la ingeniería y el empleo de modelos computacionales?DGG. Creo que debe promoverse la búsqueda de sinergias entre los campos de la ingeniería y la medicina. De hecho, pienso que tanto nacional como internacionalmente, ésta es una de las apuestas principales en el área de la investigación. Ejemplos de esto son el incremento de financiación para proyectos en bioingeniería o la creación de estudios de grado y postgrado en este campo. Mi reflexión personal después de haber participado en este tipo de investigaciones y trabajos es que debemos salir de nuestra zona de confort e impulsar equipos multidisciplinares. De esta forma, expertos en distintas temáticas pueden abordar problemas complejos y dar respuestas que consideren las distintas problemáticas de una manera conjunta. Un ejemplo claro es el apoyo a cirujanos mediante modelos computacionales, que puede ir desde el diseño y optimización de prótesis hasta simulaciones del proceso quirúrgico, anticipando complicaciones durante la cirugía y proporcionando posibles soluciones.Desde My Scientific le hacemos llegar nuestra sincera enhorabuena al Dr. Daniel García González por la reciente concesión de una ayuda ERC (Consejo Europeo de Investigación) Starting Grant. ¡Felicidades!
Documentación y Entrevista
Beatriz Martínez Poveda para My Scientific Journal
08/09/2020
08/09/2020

Beatriz Martínez PovedaRedactora My Scientific
Profesora Universidad de Málaga
