Dr. Ángel Fernández Bravo

Prólogo My Scientific Journal: Los métodos de diagnóstico y estudio de múltiples enfermedades pasan por la utilización de la llamada “imagen in vivo”, una tecnología que permite a médicos e investigadores obtener información de suma valía de una forma segura y fiable, y, lo que es más importante: de una forma no invasiva. No tenemos que irnos muy lejos, los conocidos rayos X son, con sus limitaciones, la primera aproximación a estos métodos, que han evolucionado enormemente y ya están ampliamente instaurados en nuestro día a día (pensemos en la resonancia magnética nuclear, la ecografía, el PET…).
Sin embargo, la investigación no cesa en el estudio de nuevas herramientas que, de forma más eficiente y resolutiva, puedan mejorar la tecnología de la imagen in vivo, haciéndola más potente. Prueba de ello son los trabajos de altísima relevancia y calidad del Dr. Ángel Fernández Bravo, investigador en el Lawrence Berkeley National Laboratory (California, US). Los artículos del Dr. F. Bravo suponen toda una revolución en el uso de los nanoláseres aplicados a la biofotónica, y han sido publicados en revistas del más alto impacto científico, como Nature Nanotechnology, Nature Materials y Nature Communications (su aportación en esta revista ha sido destacada en Nature como uno de los 20 mejores artículos en Física, Ciencia de Materiales, y Química del 2018) (ver referencias 7, 8 y 14). Desde My Scientific Journal nos sentimos profundamente honrados con la contribución que amablemente ha realizado el Dr. Fernández Bravo, en la que nos describe con detalle puntos clave de sus investigaciones.

Figura 1. Propiedades de la luz para varias fuentes. La luz solar exhibe una radiación incoherente no monocromática, mientras que la luz LED puede ser monocromática pero incoherente, y los láseres con propiedades de emisión monocromáticas y coherentes. Ein es para el campo eléctrico de entrada, E0 el campo eléctrico dentro de la cavidad, m es el espejo, x(t) es el desplazamiento del espejo, y dλ es el desplazamiento espectral.

Una de las principales innovaciones consiste en trasladar estos éxitos de la emisión espontánea utilizada en trabajos anteriores a la tecnología láser. Los nuevos nanoláseres pueden activarse utilizando luz IR que no es absorbida por los tejidos, y convertir localmente la energía en luz láser de banda estrecha de frecuencias más cortas. Esto permite una penetración más profunda y abordar tejidos de volúmenes pequeños y bien definidos. Se espera que los láseres puedan situarse a una profundidad de hasta centímetros, donde la luz de 1450 nm aún puede penetrar para excitarlos, comparado con el límite de 100 µm de profundidad para la luz verde, o 1 mm para la luz corta del NIR [11].
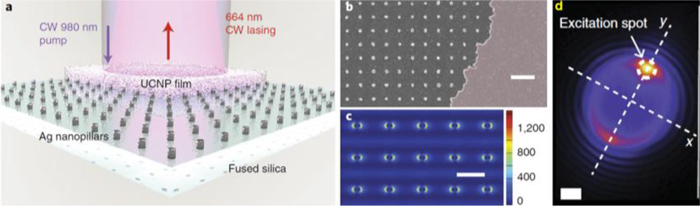
Recientemente, he descubierto nuevas clases de micro y nanoláseres multifotónicos que pueden funcionar a temperatura ambiente (y también a temperaturas fisiológicas), y que pueden ser excitados en el infrarrojo cercano y por medio de onda continua (CW) en lugar de una excitación pulsada [7,8] (Fig. 3). Los láseres se basan en nanopartículas UCNP cuyas emisiones (660, 800 nm) se desplazan cientos de nanómetros con respecto a la energía de excitación (980, 1064 nm). Por lo tanto, estos láseres presentan una emisión sin ruido de fondo (no se requiere ningún filtro, lo cual permite diseños ópticos más sencillos) y por lo tanto tienen un mayor contraste en comparación con otras fuentes de láser. Estos diseños simplificados funcionan en casi cualquier longitud de onda. Adicionalmente, parte de los esfuerzos de fabricación se basan en la química coloidal, y por lo tanto permiten un escalado agresivo, mucho más allá de lo que se consigue con la nanolitografía. El nuevo diseño del láser preservará la integridad del tejido operando a longitudes de onda (IR) y potencias (W/cm2) seguras [9] con tamaños menores a 2,5 µm causando poca alteración en el tejido vivo.
Esta investigación podría suponer un cambio de paradigma en el uso de pequeños láseres para la biomedicina, para la detección precoz de enfermedades, y constituir una parte integral de las terapias, por ejemplo, actuando sobre órganos específicos como el corazón, los nervios periféricos y las neuronas del cerebro, todo ello utilizando la luz. Esto reducirá la carga de energía, el tiempo y el costo de un dispositivo funcional. Y podría incluso ser usado para detectar y tratar infecciones virales minimizando la carga de agente invasor de manera oportuna antes de que cause alteraciones biológicas.
Referencias
2. Optical Communication and Networking Equipment Market. 11. https://www.marketsandmarkets.com/MarketReports/Optical- networking-communications-market-227693036.html (2020).
3. Silicon Photonics Market. https://www.marketsandmarkets.com/Market- 12. Reports/silicon-photonics-116.html (2020).
4. Schubert, M. et al. Monitoring contractility in cardiac tissue with 13. cellular resolution using biointegrated microlasers. Nat. Photonics 14, 452–458 (2020).
5. Information, S. Lasing within live cells containing intracellular optical 14. micro- resonators for barcode-type cell tagging and tracking. 1–3.
6. Humar, M. & Yun, S. H. Intracellular microlasers. Nat. Photonics 9, 15. 572–577 (2015).
7. Fernandez-bravo, A. et al. Continuous-wave upconverting nanoparticle microlasers. Nat. Nanotechnol. 13, 572– 577 (2018).
8. Fernandez-Bravo, A. et al. Ultralow-threshold, continuous-wave upconverting lasing from subwavelength plasmons. Nat. Mater. 18, 1172–1176 (2019).
9. DeLisi, M. P. et al. Suprathreshold laser injuries in excised porcine skin for millisecond exposures at 1070 nm. J. Biomed. Opt. 23, 1 (2018).
10. Hong, G. et al. Through-skull fluorescence imaging of the brain in a new near-infrared window. Nat. Photonics 8, 723–730 (2014).
11. Levy, E. S. et al. Energy-looping nanoparticles : Harnessing excited- state absorption for deep-tissue imaging. ACS Nano 10, 8423–8433 (2016).
12. Lee, C. et al. Giant nonlinear optical responses from photon avalanching nanoparticles.
13. Zhou, M. et al. The Bioavailability, Biodistribution, and Toxic Effects of Silica-Coated Upconversion Nanoparticles in vivo. Front. Chem. 7, 218 (2019).
14. Tian, B. et al. Low irradiance multiphoton imaging with alloyed lanthanide nanocrystals. Nat. Commun. 9, 3082(2018).
15. Liu, Y. et al. Amplified stimulated emission in upconversion nanoparticles for super-resolution nanoscopy. Nature 543, 229–233 (2017).
16. Chen, C. et al. Multi-photon near-infrared emission saturation nanoscopy using upconversion nanoparticles. Nat. Commun. 9, 1–6 (2018).
17. Liu, Y. et al. Controlled Assembly of Upconverting Nanoparticles for Low-Threshold Microlasers and Their Imaging in Scattering Media. ACS Nano 14, 1508–1519 (2020).
Documentación y redacción

