ISSN 2660-9134 | Diciembre 2020 | Volumen 4 | Artículo 6
Cuando uno se enfrenta al estudio de macromoléculas, ya sea en secundaria o en grados universitarios, es frecuente acabar con una imagen similar a un juego de construcción. Me explico: los ácidos nucleicos están formados por nucleótidos, los polisacáridos por monosacáridos y las proteínas por aminoácidos. En estos tres ejemplos, se “construye” una macromolécula a partir de “piezas pequeñas” denominados sillares estructurales, los cuales se ensamblan para dar lugar desde un pequeño muro de piezas de colores hasta el Halcón Milenario de Star Wars.
En el caso de las proteínas, las piezas de construcción –los aminoácidos- determinan en gran medida la utilidad –la función- del resultado final. Existe un gran número de ejemplos de mutaciones en el material genético que se traducen en proteínas funcionalmente distintas. Estas mutaciones hacen que se use una pieza roja en vez de la verde que debería ir en ese determinado lugar. Aquí lo represento como un cambio de color, aparentemente sin más consecuencia que un cambio estético. Sin embargo, un cambio de aminoácido en una proteína puede tener consecuencias drásticas en lo que a su función se refiere. De muestra, un botón: la mutación D614G (el glutamato en posición 614 se sustituye por una glicina) de la proteína de la espiga (spike) del SARS-CoV 2 hace que el virus adquiera mayor capacidad infectiva en el epitelio del pulmón.
Una vez que tenemos esta imagen de piezas que se combinan para dar lugar a una proteína funcional, deberíamos incluir una manera de regular su función dependiendo de las circunstancias. Pues bien, no hay una única manera: hay muchas. Desde la regulación por la cantidad de proteína (balance entre síntesis y degradación), pasando por la regulación por parte de pequeños metabolitos o cofactores (regulación alostérica), hasta la regulación por modificación covalente de proteínas. Este último mecanismo es el que he querido tratar en este artículo.
La modificación covalente de proteínas (también llamada modificación postraduccional) consiste en la incorporación de un sustituyente en determinados aminoácidos. Sería como ponerse un piercing o un collar: un adorno que se coloca o se elimina en función de las circunstancias.
El primer ejemplo de modificación covalente y reversible de proteínas para modular su actividad fue la fosforilación. El trabajo de Edwing G. Krebs y Edmond H. Fischer en la década de los 50s del siglo XX fue clave para describir este proceso y, por este motivo, recibieron el
En el caso de las proteínas, las piezas de construcción –los aminoácidos- determinan en gran medida la utilidad –la función- del resultado final. Existe un gran número de ejemplos de mutaciones en el material genético que se traducen en proteínas funcionalmente distintas. Estas mutaciones hacen que se use una pieza roja en vez de la verde que debería ir en ese determinado lugar. Aquí lo represento como un cambio de color, aparentemente sin más consecuencia que un cambio estético. Sin embargo, un cambio de aminoácido en una proteína puede tener consecuencias drásticas en lo que a su función se refiere. De muestra, un botón: la mutación D614G (el glutamato en posición 614 se sustituye por una glicina) de la proteína de la espiga (spike) del SARS-CoV 2 hace que el virus adquiera mayor capacidad infectiva en el epitelio del pulmón.
Una vez que tenemos esta imagen de piezas que se combinan para dar lugar a una proteína funcional, deberíamos incluir una manera de regular su función dependiendo de las circunstancias. Pues bien, no hay una única manera: hay muchas. Desde la regulación por la cantidad de proteína (balance entre síntesis y degradación), pasando por la regulación por parte de pequeños metabolitos o cofactores (regulación alostérica), hasta la regulación por modificación covalente de proteínas. Este último mecanismo es el que he querido tratar en este artículo.
La modificación covalente de proteínas (también llamada modificación postraduccional) consiste en la incorporación de un sustituyente en determinados aminoácidos. Sería como ponerse un piercing o un collar: un adorno que se coloca o se elimina en función de las circunstancias.
El primer ejemplo de modificación covalente y reversible de proteínas para modular su actividad fue la fosforilación. El trabajo de Edwing G. Krebs y Edmond H. Fischer en la década de los 50s del siglo XX fue clave para describir este proceso y, por este motivo, recibieron el
premio Nobel en el año 1992 (sólo tuvieron que esperar cuatro décadas). Las implicaciones de la incorporación de un grupo fosfato en los aminoácidos serina o treonina inmersos en la estructura de una proteína se visualizaban fácilmente. Se trata de la introducción de dos cargas negativas en aminoácidos que tan sólo pueden presentar una carga negativa parcial. La incorporación del grupo fosfato introduce fuerzas electrostáticas (tanto de atracción como de repulsión) que alteran la estructura de la proteína, lo cual que se traduce en un cambio funcional.Además de en serina o treonina, la fosforilación puede darse en tirosinas. Estos tres aminoácidos presentan un grupo hidroxilo (-OH) en la cadena lateral, sustituyente necesario para la unión covalente del fosfato. Pues bien, la demostración de que la fosforilación se puede dar también en la cadena lateral de la tirosina tardó aún casi tres décadas más (fue a principios de los 80s). El motivo fue que es mucho menos frecuente (aproximadamente un 0,03% de todos los aminoácidos fosforilados en una célula) por un lado, y que fue necesario un error en el pH de un tampón para poder distinguir entre fosfo-treonina y fosfo-tirosina, por otro. Sí, el mito de los errores en ciencia que dan lugar a importantes descubrimientos sigue vivo (alguien, en algún lugar, lo habrá experimentado en sus carnes).
Además de la fosforilación, una de las modificaciones post-traduccionales principales que tienen lugar en la célula es la acetilación: incorporación de un grupo acetilo procedente del Acetil-Coenzima A. Este “adorno” no es tan llamativo como la fosforilación. Es algo más sutil; elimina la carga positiva del grupo amino (a pH fisiológico) de la cadena lateral de la lisina añadiendo tan sólo un par de carbonos. Los primeros ejemplos de proteínas con acetilaciones en lisinas fueron las histonas, cuya acetilación tiene una consecuencia estructural en lo que respecta al empaquetamiento del material genético. Esta modificación provoca el debilitamiento de la interacción de las histonas con el DNA, de tal forma que se hace más accesible para la maquinaria de transcripción génica (las proteínas que van a “leer” el material genético). Así, se asume que un mayor grado de acetilación en histonas se correlaciona con una mayor tasa de transcripción génica. No obstante, como en el caso de la fosforilación, no siempre que se acetila una proteína provoca un aumento en su actividad.
De entre el resto de modificaciones postraduccionales que pueden tener lugar en la célula me gustaría destacar uno más: la ubiquitinación. Anteriormente he mencionado los mecanismos de regulación de la actividad de proteínas: regulación de la cantidad de proteína (síntesis y degradación), regulación por pequeños metabolitos o cofactores y las modificaciones covalentes. Pues bien, la ubiquitinación es una modificación covalente que determina la degradación de la proteína en cuestión. Es una modificación postraduccional que marca a la proteína que ha de desaparecer. Es más, esta ubiquitinación puede ser impedida por… sí, acetilación. Esto es debido a que las dos ocurren en residuos de lisina. Dos ejemplos interesantes los constituyen el factor de transcripción FOXO1 y el co-activador transcripcional CRTC2 en el hígado en situación de ayuno (Figura 1). Ambas proteínas se regulan por fosforilación, de tal forma que si se encuentran fosforiladas son “secuestradas” en el citosol, alejadas del núcleo celular donde pueden activar genes. El ayuno ocasiona la eliminación del fosfato, permitiendo su viaje al núcleo de la célula. Una vez en el lugar donde pueden realizar su función, son acetiladas por las mismas proteínas que acetilan a histonas (acetil-transferasas de histonas o HAT). Pero, cuidado, vayamos por orden. Ambas proteínas se acetilan con consecuencias opuestas. FOXO1 permanece inactivo en el núcleo y CRTC2 es activo en las primeras fases del ayuno. La acetilación de CRTC2 impide su ubiquitinación para ser degradado, ya que la ubiquitinación se produce en la misma lisina que se acetila. Así, llega un momento en el que se elimina el acetilo de CRTC2 (es una deacetilasa que es sensible al nivel energético de la célula –SirT1- la que lo elimina), permitiendo la ubiquitinación y su degradación. Pero esta misma deacetilasa también elimina el acetilo de FOXO1 y, ahora sí, es activo para continuar activando los genes de respuesta al ayuno, en este caso, prolongado. Este ejemplo es ilustrativo de la variedad de consecuencias de las modificaciones post-traduccionales. En otras palabras, hay un adorno para cada ocasión y a cada proteína “le sienta” de una manera.
Además de la fosforilación, una de las modificaciones post-traduccionales principales que tienen lugar en la célula es la acetilación: incorporación de un grupo acetilo procedente del Acetil-Coenzima A. Este “adorno” no es tan llamativo como la fosforilación. Es algo más sutil; elimina la carga positiva del grupo amino (a pH fisiológico) de la cadena lateral de la lisina añadiendo tan sólo un par de carbonos. Los primeros ejemplos de proteínas con acetilaciones en lisinas fueron las histonas, cuya acetilación tiene una consecuencia estructural en lo que respecta al empaquetamiento del material genético. Esta modificación provoca el debilitamiento de la interacción de las histonas con el DNA, de tal forma que se hace más accesible para la maquinaria de transcripción génica (las proteínas que van a “leer” el material genético). Así, se asume que un mayor grado de acetilación en histonas se correlaciona con una mayor tasa de transcripción génica. No obstante, como en el caso de la fosforilación, no siempre que se acetila una proteína provoca un aumento en su actividad.
De entre el resto de modificaciones postraduccionales que pueden tener lugar en la célula me gustaría destacar uno más: la ubiquitinación. Anteriormente he mencionado los mecanismos de regulación de la actividad de proteínas: regulación de la cantidad de proteína (síntesis y degradación), regulación por pequeños metabolitos o cofactores y las modificaciones covalentes. Pues bien, la ubiquitinación es una modificación covalente que determina la degradación de la proteína en cuestión. Es una modificación postraduccional que marca a la proteína que ha de desaparecer. Es más, esta ubiquitinación puede ser impedida por… sí, acetilación. Esto es debido a que las dos ocurren en residuos de lisina. Dos ejemplos interesantes los constituyen el factor de transcripción FOXO1 y el co-activador transcripcional CRTC2 en el hígado en situación de ayuno (Figura 1). Ambas proteínas se regulan por fosforilación, de tal forma que si se encuentran fosforiladas son “secuestradas” en el citosol, alejadas del núcleo celular donde pueden activar genes. El ayuno ocasiona la eliminación del fosfato, permitiendo su viaje al núcleo de la célula. Una vez en el lugar donde pueden realizar su función, son acetiladas por las mismas proteínas que acetilan a histonas (acetil-transferasas de histonas o HAT). Pero, cuidado, vayamos por orden. Ambas proteínas se acetilan con consecuencias opuestas. FOXO1 permanece inactivo en el núcleo y CRTC2 es activo en las primeras fases del ayuno. La acetilación de CRTC2 impide su ubiquitinación para ser degradado, ya que la ubiquitinación se produce en la misma lisina que se acetila. Así, llega un momento en el que se elimina el acetilo de CRTC2 (es una deacetilasa que es sensible al nivel energético de la célula –SirT1- la que lo elimina), permitiendo la ubiquitinación y su degradación. Pero esta misma deacetilasa también elimina el acetilo de FOXO1 y, ahora sí, es activo para continuar activando los genes de respuesta al ayuno, en este caso, prolongado. Este ejemplo es ilustrativo de la variedad de consecuencias de las modificaciones post-traduccionales. En otras palabras, hay un adorno para cada ocasión y a cada proteína “le sienta” de una manera.
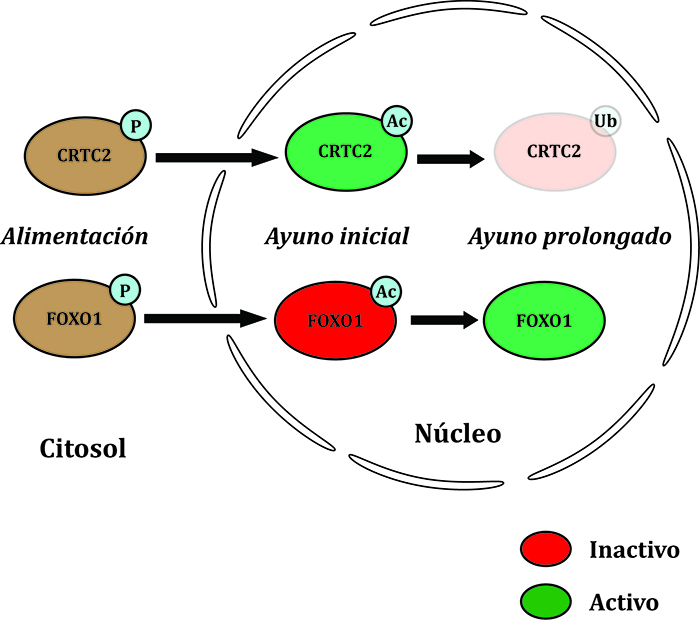
Figura 1. Esquema de las consecuencias de las modificaciones postraduccionales en las proteínas CRTC2 y FOXO1 (adaptado de Klaus Kaestner, Cell Metabolism, 2008; DOI: 10.1016/j.cmet.2008.11.003)
Artículo realizado por:
José Carlos Paz para My Scientific Journal 08/12/2020

José Carlos PazRedactor My Scientific Journal
Profesor Sustituto Interino en Universidad de Málaga
